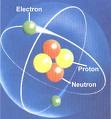
เนื่องจากอะตอมของแต่ละธาตุมีมวลน้อยมาก เช่น อะตอมของไฮโดรเจนมีมวล 1.66 * 10-24 กรัม อะตอมของออกซิเจนมีมวล 2.65 * 10-23 กรัม ทำให้ไม่สามารถชั่งมวลของธาตุ 1 อะตอมได้โดยตรง ดอลตันจึงได้พยายามหามวลอะตอมของแต่ละธาตุโดยใช้วิธีการเปรียบเทียบว่าอะตอมาตุชนิดหนึ่งมีมวลเป็นกี่ท่าของอะตอมของอีกธาตุหนึ่งที่กำหนดให้เป็นมาตรฐาน ดอลตันได้พบว่าไฮโดรเจนเป็นธาตุที่อะตอมมีมวลน้อยที่สุด จึงเสนอให้ใช้ไฮโดรเจนเป็นธาตุมาตรฐานในการเปรียบเทียบเพื่อหามวลอะตอมของธาตุอื่นๆ โดยกำหนดให้ไฮโดรเจน 1 อะตอมมีมวลเป็น 1 หน่วย ด้วยวิธีการเช่นนี้ อะตอมของคาร์บอนมีมวลเป็น 12 เท่าของไฮโดรเจนก็จะมีมวลเป็น 12 หน่วย อะตอมของออกซิเจนมีมวลเป็น 16 เท่าของไฮโดรเจนก็จะมีมวลเป็น 16 หน่วย ตัวเลขที่ได้จากการเปรียบเทียบมวลของธาตุ 1 อะตอมกับมวลของธาตุมาตรฐาน 1 อะตอม เรียกว่า มวลอะตอมของธาตุ
ต่อมานักวิทยาศาสตร์จึงได้ตกลงใช้คาร์บอน-12 ซึ่งเป็นไอโซโทปหนึ่งของคาร์บอนเป็นมาตรฐานในการเปรียบเทียบมวล เนื่องจากธาตุคาร์บอนสามารถทำปฏิกิริยากับธาตุอื่นๆ เกิดเป็นสารประกอบได้เป็นจำนวนมาก และคาร์บอน-12 เป็นไอโซโทปที่มีปริมาณสูงกว่าไอโซโทปอื่นๆ ของคาร์บอนอีกด้วย โดยกำหนดให้คาร์บอน-12 จำนวน 1 อะตอมมีมวล 12 หน่วยมวลอะตอม ดังนั้น 1 หน่วยมวลอะตอมจึงมีค่าเท่ากับ 1/12 มวลของคาร์บอน-12 จำนวน 1 อะตอมหรือเท่ากับ 1.66 * 10-24 กรัม ค่าของมวลอะตอมของธาตุจึงเขียนเป็นความสัมพันธ์ไดดังนี้

ธาตุส่วนใหญ่ในธรรมชาติมีหลายไอโซโทป และแต่ละไอโซโทปมีปริมาณมากน้อยต่างกัน มวลอะตอมของคาร์บอนที่คำนวณได้นี้เป็นค่ามวลอะตอมที่เฉลี่ยของคาร์บอน ซึ่งสอดคล้องกับค่ามวลอะตอมของธาตุที่ปรากฏอยู่ในธรรมชาติ ดังนั้นค่ามวลอะตอมของธาตุใดๆ ในตารางธาตุจึงเป็นค่ามวลอะตอมเฉลี่ยซึ่งขึ้นอยู่กับค่ามวลอะตอมและปริมาณของแต่ละไอโซโทปที่พบอยู่ในธรรมชาติ ปัจจุบันนี้นักวิทยาศาสตร์จึงหามวลอะตอมและปริมาณของไอโซโทปของแต่ละธาตุ โดยใช้เครื่องมือเรียกว่า แมสสเปกโตรมิเตอร์ ทำให้ได้ค่าที่แน่นอนและมีความถูกต้องสูง

ตัวอย่างเช่น การคำนวณหามวลของ Li 3.01 x 1024 อะตอม จากข้อมูลต่อไปนี้
| ไอโซโทป |
%ที่มีในธรรมชาติ |
มวลอะตอม |
 |
7.00 |
6.0200 |
 |
93.00 |
7.0100 |

แหล่งอ้างอิง: 1. เอกสารประกอบคำบรรยาย วิชาเคมี ของโครงการส่งเสริมความสามารถพิเศษภาคฤดูร้อน Brands's Summer Camp'95 มหาวิทยาลัยเกษตรศาสตร์
2. หนังสือเรียนวิชาเคมี 2 ว 036 ฉบับปรับปรุง พ.ศ. 2533 ของกระทรวงศึกษาธิการ จัดทำโดยสถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี พิมพ์ครั้งที่หนึ่ง พ.ศ. 2541
เต็งลั้ง โคมแดง โคมจีน โคมเต็งลั้ง โคมผ้ากำหมะหยี่ (ราคาต่อคู่) โคมตรุษจีน แขวนหน้าบ้าน ร้านค้า #60 #80 #100 #120
฿949 https://s.shopee.co.th/4q9unuFgOX?share_channel_code=6
Advertisement

เปิดอ่าน 19,813 ครั้ง 
เปิดอ่าน 104,561 ครั้ง 
เปิดอ่าน 46,349 ครั้ง 
เปิดอ่าน 15,916 ครั้ง 
เปิดอ่าน 22,482 ครั้ง 
เปิดอ่าน 11,516 ครั้ง 
เปิดอ่าน 35,191 ครั้ง 
เปิดอ่าน 2,702 ครั้ง 
เปิดอ่าน 16,459 ครั้ง 
เปิดอ่าน 15,692 ครั้ง 
เปิดอ่าน 42,219 ครั้ง 
เปิดอ่าน 26,655 ครั้ง 
เปิดอ่าน 18,788 ครั้ง 
เปิดอ่าน 36,686 ครั้ง 
เปิดอ่าน 25,870 ครั้ง 
เปิดอ่าน 31,347 ครั้ง |

เปิดอ่าน 74,543 ☕ คลิกอ่านเลย |

เปิดอ่าน 20,774 ☕ คลิกอ่านเลย | 
เปิดอ่าน 20,482 ☕ คลิกอ่านเลย | 
เปิดอ่าน 36,686 ☕ คลิกอ่านเลย | 
เปิดอ่าน 107,713 ☕ คลิกอ่านเลย | 
เปิดอ่าน 28,523 ☕ คลิกอ่านเลย | 
เปิดอ่าน 24,637 ☕ คลิกอ่านเลย |
|
≡ เรื่องน่าอ่าน/สาระน่ารู้ ≡ 
เปิดอ่าน 16,393 ครั้ง | 
เปิดอ่าน 22,219 ครั้ง | 
เปิดอ่าน 12,196 ครั้ง | 
เปิดอ่าน 15,610 ครั้ง | 
เปิดอ่าน 16,530 ครั้ง |
|
|